Artigo Original 1 - Ficocianina na Terapêutica de Lesões Cutâneas Induzidas em Ratos Envelhecidos
Abstract
RESUMO
O objetivo deste trabalho foi avaliar a ação da fi cocianina na terapêutica de lesões cutâneas induzidas em ratos envelhecidos.
Utilizaram-se 40 ratos machos envelhecidos com lesões de pele induzidas, divididos em 4 grupos: G1 (Ficocianina
10%); G2 (Ficocianina 20%); G3 (Ficocianina 30%) e G4 (Controle positivo - Kollagenase®). Essas lesões foram analisadas
quanto à contração cicatricial, quantidade de colágeno total, fi brose e células infl amatórias. Para análise estatística,
foram utilizados o software Bioestat 5.0 e a comparação entre os tratamentos e, entre os parâmetros, foi utilizado
o teste não paramétrico de Kruskal-Wallis, em nível de signifi cância de 5%. Os resultados com a pomada fi cocianina
nas diferentes concentrações não apresentaram diferença estatística signifi cativa quando comparados aos resultados
da pomada Kollagenase®, porém, a pomada fi cocianina na concentração de 30% mostrou resultado semelhante
à pomada de referência. Conclui-se que o uso da fi cocianina em uma concentração de 30 % contribuiu positivamente
para cicatrização de feridas cutâneas em ratos.
DESCRITORES: Cicatrização. Ficocianina. Envelhecimento.
INTRODUÇÃO
A pele é um órgão complexo, no qual a interação celular
e molecular reguladas de modo preciso governam muitas
das agressões provindas do meio ambiente. É constituída
por vários tipos de células interdependentes responsáveis
pela manutenção da sua estrutura normal. Com o envelhecimento
cronológico cutâneo, ocorre a modi cação do
material genético por meio de enzimas, alterações proteicas
e o decréscimo da proliferação celular1. Esses eventos
promovem a perda de tecido, da elasticidade e da capacidade
de regular as trocas gasosas. A replicação do tecido se
torna menos e ciente. As oxidações químicas e enzimáticas
envolvendo a formação de radicais livres (RL) aceleram o
processo de senescência2.
Com o envelhecimento, ocorrem modi cações nas células,
resultando em uma diminuição da imunidade devido
à redução das células de Langerhans, aumentando, dessa
forma, o risco de lesões na pele. Aliado a isso, ocorre também
a diminuição dos melanócitos, o que reduz a proteção
aos raios solares, a diminuição da produção de suor pelas
glândulas sudoríparas, (resultando numa menor capacidade
de termorregulação), bem como a redução da vascularização
e da produção de colágeno3. Uma das consequências
das lesões de pele é a prevalência da polifarmácia, aumentando
o risco de reações autoimunes, porque a administração
concomitante de vários medicamentos pode criar uma
sensibilidade muito maior para erupções da droga, podendo
simular outras afecções cutâneas4.
Nesse contexto, a busca de novas alternativas para o
tratamento de lesões de pele torna-se bastante importante.
Existem perspectivas de desenvolvimento de novas tecnologias
que visam a acelerar o processo cicatricial e reduzir as complicações
que essas lesões podem acarretar5.
A cicatrização é reconhecida como um processo sistêmico
que consiste em uma complexa sequência de eventos
coordenados e desencadeados pelo organismo que objetiva
reconstruir o tecido lesado sendo este substituído por tecido
conjuntivo vascularizado broso5,6. Inicia-se com resposta
in amatória caracterizada pelo aumento do uxo sanguíneo,
permeabilidade capilar, migração de leucócitos para
a região lesada e extravasamento de plasma, formando o
exsudato in amatório7,8.
A cicatrização das feridas de espessura parcial ocorre
por regeneração das células epiteliais na superfície da ferida,
essas células migram em direção à área lesionada, proliferando-
se por mitose e incorporando-se à camada epitelial9.
Já, nas feridas de espessura total, o processo de cicatrização
ocorre por segunda intenção e é bem mais complexo, envolvendo
uma sequência de eventos moleculares e celulares de
forma ordenada e contínua10. Essa sequência, sob o ponto
de vista morfológico, é classi cada em três fases: in amatória,
proliferativa e de remodelamento11.
A fase in amatória e de hemostasia representa a primeira
fase de qualquer processo de cicatrização, inicia-se
com a ruptura de vasos sanguíneos e o extravasamento de
sangue e caracteriza-se pela participação ativa de inúmeras
células e fatores do sistema imunológico12. Essa fase tem
duração de 48 a 72 horas, com então aparecimento de dor,
calor, rubor e edema, sinais clássicos da in amação13.
A segunda fase é a broblástica, também chamada de
fase reconstrutiva ou proliferativa, denominada dessa forma
porque, nesse período, a atividade predominante é a mitose
celular. Essa fase se estende de 12 a 14 dias6,9. As principais
características nessa fase são a formação do tecido de granulação,
neoangiogênese, deposição de colágeno, contração da
ferida e reepitelização. Para a síntese desses componentes,
os principais agentes estimulantes são as células endoteliais,
os broblastos e os queratinócitos3 .
A terceira fase é a de remodelamento, também denominada
por alguns autores de fase de maturação, e consiste
na reorganização das bras de colágeno e na substituição
do colágeno tipo III (imaturo) depositado de forma
desorganizada pelo colágeno tipo I (maduro) disposta de
forma organizada3 .
Em diversos setores da área de saúde, o tratamento
de feridas vem sendo um tema em destaque e a preocupação
na busca de produtos que promovam a cicatrização é
uma constante. Essa é uma prática milenar que, nos primórdios
da civilização, estava intimamente ligada a costumes
e hábitos populares e, com o desenrolar da história e
do desenvolvimento tecnológico, conquistou seu merecido
cunho cientí co9 .
Dentre as novas tecnologias, encontra-se a Ficocianina,
um pigmento extraído da Micoalga Spirulina platensis . Seu
peso seco pode chegar a 20%14 , é considerada a principal
responsável pela atividade antioxidante e apresenta capacidade
de ativar o sistema imunológico15 .
O uso desse pigmento pode acelerar os processos de
cicatrização de feridas, haja vista a sua riqueza em vitamina
A e capacidade bactericida, pela presença de 2,4,4
tricloro-2 hidroxi-difenil-éter, o qual é utilizado no tratamento
de processos infecciosos16 . O potencial terapêutico
da Ficocianina tem sido relatado para ns terapêuticos em
humanos e também em animais17 .
A microalga possui e ciente atividade antiviral contra
vários vírus patógenos e tem também a capacidade
de aumentar a resposta imunológica e estimular a função
dos macrófagos18 .
Existem muitas informações acerca do uso da
Ficocianina como medicamento, entre elas, cita-se o
poder de cicatrização, mas ainda são insu cientes para
sua comprovação.
Ao partirmos do pressuposto que a Ficocianina acelera
o processo de cicatrização em lesões de pele, este estudo
possui o seguinte objetivo: veri car a ação da cocianina
na terapêutica de lesões cutâneas induzidas em ratos envelhecidos
com relação à contração cicatricial, quantidade de
colágeno total, brose e células in amatórias em comparação
com produto de referência – Kollagenase®.
MÉTODO
Os experimentos foram realizados no Biotério Central e
no Laboratório de Bioquímica e Histologia do Instituto
de Ciências Biológicas (ICB) da Universidade de Passo
Fundo (UPF). Foram adotados os Princípios Éticos em
Experimentação Animal, preconizados pelo Colégio Brasileiro
de Experimentação Animal (COBEA), instituição liada
ao International Council for Laboratory Animal Science e a
Legislação Brasileira de Animais de Experimentação, Lei
Federal n.º 6.638 (1979).
A Comissão de Ética no Uso de Animais da Universidade
de Passo Fundo (CEUA-UPF) aprovou o projeto desta pesquisa
com o parecer 007/2011, com registro de número 002/2011
na CEUA, que diz respeito à vida dos animais utilizados.
Foram utilizados 40 ratos (Wistar hannover ) machos,
nascidos e mantidos no Biotério Central da UPF, com idade
aproximada de 400 dias, alimentados com ração e água ad
libitum e com ciclo claro-escuro de 12 horas. Eles foram
divididos em quatro grupos com nº de 10 animais, e cada
grupo recebeu um tipo de tratamento conforme segue:
• grupo 1 - G1 (Ficocianina 10%);
• grupo 2 - G2 (Ficocianina 20%);
• grupo 3 - G3 (Ficocianina 30%) e
• grupo 4 - G4 (Controle positivo – Kollagenase®) pomada
de referência. Durante todo o período de estudo, os
animais foram mantidos em gaiolas individuais, identi
cadas e acomodados sobre estantes horizontais.
A pomada Kollagenase®, utilizada no grupo controle,
foi usada como pomada de referência comercial no efeito
cicatrização, a qual possui Registro no Ministério da Saúde
sob nº 1.0298.0049, um brinolítico de uso adulto com
ações terapêuticas cicatrizantes.
A Ficocianina foi obtida no Laboratório de Bioquímica
de Alimentos e de Bioprocessos da UPF. Esse pigmento
foi extraído da cianobactéria Spirulina platensis , a qual foi
procedente do Laboratório de Engenharia Bioquímica da
Fundação Universidade Federal de Rio Grande – FURG.
A manipulação dessa pomada foi realizada pela farmácia
de manipulação Artesani da cidade de Erechim/RS,
Brasil. Os excipientes para formulação da pomada foram
o extrato de Ficocianina nas porcentagens utilizadas para
cada grupo, 10, 20 e 30%, as quais foram adicionadas em
creme base na quantidade su ciente para completar a
fórmula (QSP).
Os animais foram submetidos a jejum de 2 horas prévias
ao procedimento cirúrgico. Para os procedimentos
cirúrgicos, os ratos, após pesados, foram anestesiados com
o uso de Zoletil 50 mg, sendo administrado via intramuscular
na dose de 40 mg/kg de peso corporal no músculo da
panturrilha dos ratos.
A técnica operatória, após tricotomia, consistiu em excisão
de espessura total de pele com 20 mm de circunferência,
utilizando-se um punch para demarcar a área e auxílio
de um bisturi. A hemostasia foi realizada por compressão
digital, utilizando-se gaze esterilizada.
Para a aplicação das pomadas nos diferentes grupos,
foi realizada a limpeza da lesão com soro siológico
(NaCl 0,9%) em jato na temperatura ambiente, o qual foi
feito através de uma seringa de 20 mL com uma agulha
40x12 mm na ponta9 . Na sequência, foram aplicadas 0,5
ml da pomada utilizada em cada grupo, quantidade su -
ciente para cobrir toda a lesão que foi mantida aberta.
Esse procedimento foi realizado durante 18 dias consecutivos
uma vez por dia.
A contração cicatricial foi avaliada através da análise
computadorizada de fotos digitais padronizadas. A documentação
fotográ ca foi feita logo após o procedimento
cirúrgico e em diferentes tempos do pós-operatório (po):
0º po; 4º dia po; 12º dia po; 18º dia po.
As imagens das lesões foram digitalizadas e analisadas
pelo programa Imagem Tool e sua área quanti cada em
centímetros quadrados.
Cada imagem avaliada foi calibrada pelo programa,
utilizando a régua adjacente à ferida. A seguir, com auxílio
de um mouse, procedeu-se o contorno manual da imagem.
Astaxas de contração cicatricial das feridas excecionais
foram obtidas subtraindo-se a área cruenta inicial
do pós-operatório imediato, em cada animal, pela área
cruenta em cada tempo pós-operatório.
As biópsias foram realizadas no sétimo dia de
pós-operatório por excisão da área total da lesão e, em
seguida, foi praticada a eutanásia do animal biopsiado.
As amostras de feridas foram colocadas em frascos com
formol a 10%, identi cados e armazenados em temperatura
ambiente. Os40casos foram processados e confeccionadas
lâminas coradas pela Hematoxilina-eosina
e pelo Picro-sirius.
Para análise estatística, foi utilizado o software
Bioestat 5.0 e, para realizar a comparação entre os tratamentos
e entre os parâmetros, foi utilizado o teste não
paramétrico de Kruskal-Wallis, em nível de signi cância
de 5%. Comoteste post hoc , usou-se o método de Dunn.
Utilizou-se estatística descritiva para identi cação de
média e desvio padrão.
As lâminas foram analisadas por médico patologista,
o qual não obteve acesso a qual grupo a lâmina pertencia,
sendo que cada lâmina foi identi cada por número
arábico para a descaracterização. Foram analisados os
seguintes parâmetros: In ltrado In amatório, Colágeno e
Fibrose. Cada parâmetro foi categorizado como: 0=sem
valor para o parâmetro; X = pouco valor para o parâmetro;
XX = valor moderado para o parâmetro e XXX = valor
intenso do parâmetro.
Todos os casos foram analisados no mesmo microscópio
Nikon Eclipse E200, com objetivas E Plan 4X, 10 X,
20 X, 40 X.
Portanto, os valores obtidos na análise dos parâmetros
foram marcados como valores inteiros 0, 1, 2 e 3, respectivamente
aos valores 0, X, XX e XXX.
RESULTADOS E DISCUSSÃO
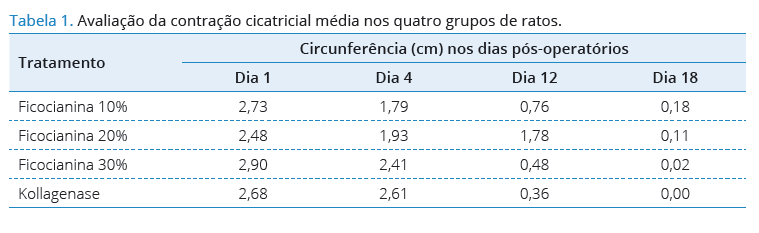
A Tabela 1 apresenta a média da avaliação da contração
cicatricial nos 4 grupos das feridas induzidas nos ratos no
dia 1, 4, dia 12 e dia 18.
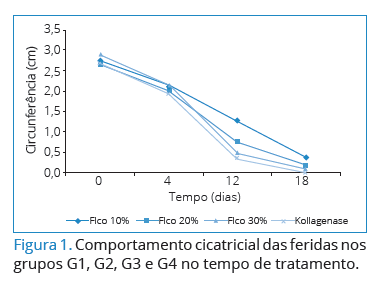
Observa-se, na Figura 1, que o comportamento cicatricial
das feridas tratadas por qualquer uma das formulações
declinou em tamanho na mesma proporção.
Exceção nesse comportamento pode ser observada para
Ficocianina a 10%.
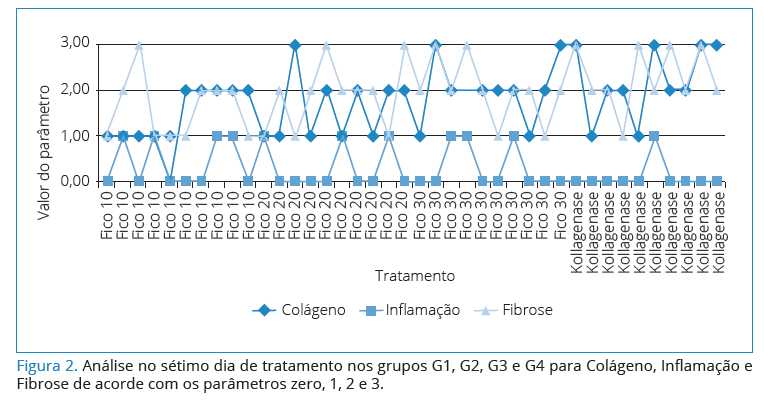
A Figura 2 retrata as quanti cações do colágeno total,
fibrose e células inflamatórias, resultados da análise no
sétimo dia, indicando os valores dos parâmetros. O valor
zero indica que não há valor para o parâmetro; 1 = pouco
valor; 2 = valor moderado; 3 = valor intenso.
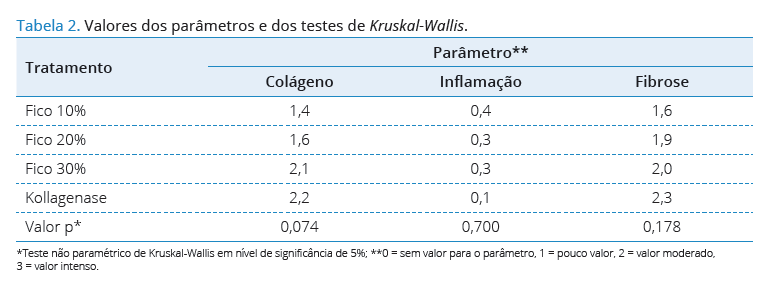
Para compor os valores de cada parâmetro, entre
os tratamentos, foi utilizado o teste não paramétrico de
Kruskal-Wallis , em nível de signi cância de 5%. Observa-se
que não existe diferença estatisticamente signi cativa entre
os valores dos parâmetros, Colágeno, In amação e Fibrose
conforme a Tabela 2.
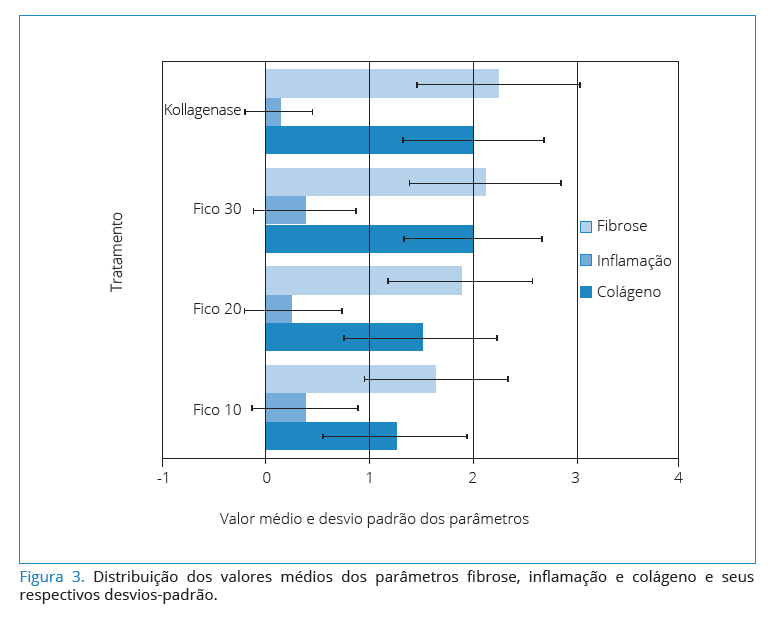
A Figura 3 apresenta a distribuição dos valores médios
dos parâmetros de cada tratamento, bem como seus respectivos
desvios-padrão. Apesar de o teste aplicado para
comparações dos valores dos parâmetros de cada tratamento
não ser paramétrico (Kruskal-Wallis ), ou seja, não se basear
na média, os pesquisadores optaram por mostrar o comportamento
médio com seus respectivos desvios-padrão,
uma vez que é uma medida estatística de mais fácil visualização.
Osvalores do desvio-padrão são relativamente
altos, conforme observados na Figura 3, em particular
para a in amação.
Nesta pesquisa, utilizou-se o rato da linhagem Wistar ,
pois, biologicamente, apresenta características facilitadoras
com relação a manuseio e acompanhamento, além de boa
resistência à manipulação, agressão cirúrgica e baixo custo.
Optou-se por utilizar ratos machos, pois variações dos ciclos
hormonais das fêmeas poderiam interferir no mecanismo
do processo de cicatrização19 .
Um estudo20 evidenciou uma desaceleração da atividade
metabólica dos broblastos com o envelhecimento
e estes perderam a sua capacidade de aderir às bras de
colágeno, limitando a possibilidade de organização do
tecido dérmico.
A quantidade de colágeno total apresenta seu primeiro
pico de produção por volta do 7º dia após a lesão, continuando
em ascensão até o 14º dia e, após, com o decorrer
da fase de remodelamento, é estabelecido um equilibro entre
a síntese e a degradação das bras colágenas21 . No presente
experimento, foi observada maior quantidade do colágeno
total das feridas excecionais do grupo G2 e G3, mostrando
que os grupos tratados com Ficocianina em maior concentração
apresentam-se em fase mais adiantada do processo
de cicatrização da lesão.
Os extratos testados de Spirulina , que dá origem a
Ficocianina, revelaram a presença de avonóides, alcalóides
e triterpinoides. Os avonóides são conhecidos por reduzir
a peroxidação lipídica não só através da prevenção ou
inibição da peroxidação lipídica, acreditando-se que seja
para aumentar a viabilidade de bras de colágeno através
da promoção da síntese de DNA. Assim, a propriedade de
cicatrização de Spirulina , pode ser atribuída aos toconstituintes
presentes nela22 .
No presente estudo, os G2 e G3, apesar de não apresentarem
valores estatísticos signi cativos, mostraram
valores semelhantes e com menor número de células
in amatórias no sétimo dia quando comparados com o
G1, podendo-se, dessa forma, concluir que, com relação
à reação in amatória, esses 2 grupos estão mais próximos
do resultado da pomada de referência (G4). Já no grupo
G1, pode-se concluir que houve um atraso na primeira
fase da cicatrização devido à presença de maior número
de células in amatórias no sétimo dia.
Um estudo comparativo entre Extrato de Levedura,
Levedura de Cerveja e Spirulina como complemento na
dieta de peixes com objetivo de avaliar o crescimento e
resposta hemato-imunológica de peixes evidenciou que a
Ficocianina possui e ciente atividade antiviral contra vários
vírus patógenos e tem capacidade de aumentar a resposta
imunológica e estimular a função dos macrófagos18 .
Em recente pesquisa23 realizada em ratos com lesões
de pele induzida, a aplicação de Ficocianina acelerou a
primeira fase da cicatrização de feridas, rea rmando os
achados deste estudo.
Durante o 2º e 3º dias pós-trauma, os broblastos agem
principalmente na proliferação e migração celular, formando
brose24 . Com estímulos adequados, os brócitos revertem-se
para o estado de broblastos e mio broblastos, reativando
sua capacidade de síntese24 .
Neste estudo, observou-se maior número de brose
no grupo tratado com pomada em maior concentração de
Ficocianina (G3), o que sugere que em tal grupo, no 7º dia
pós-operatório, a fase de proliferação celular está mais adiantada
do que nos grupos tratados com pomada em menor
concentração de Ficocianina (G1 e G2).
Em estudo23 realizado para examinar a propriedadede
cicatrização de Ficocianina em relação à proliferação de brócitos
em ratos, foi observado que a referida substância
aumentou a proliferação destes de maneira signi cativa.
Nesse mesmo estudo, os autores salientam que os dados
tangenciam o uso terapêutico da Ficocianina como agente
cicatrizante de feridas.
Neste estudo, a análise das áreas cruentas das feridas
excisionais mostrou haver maior taxa de contração, levando
a valores menores de área cruenta nos grupos tratados com
pomada em maior concentração de Ficocianina, ou seja, 30%.
Presente no tecido de granulação, o mio broblasto
é o principal tipo celular envolvido no reparo tecidual
através da deposição de componentes da matriz extracelular
(tenascina, bronectina, metaloproteinases e colágenos
I e III)25 . As melhores taxas de fechamento das feridas
dos grupos tratados com a pomada de Ficocianina 30%
podem ter relação com o número e/ou o aumento da função
dos mio broblastos.
As feridas não cicatrizadas geram problemas socioeconômicos,
com diminuição da produtividade e da qualidade
de vida dos indivíduos acometidos, o que pode
ser agravado se não for tratado com uma terapia tópica
adequada21 .
As limitações deste estudo referem-se às características
instintivas e anatômicas dos animais, não sendo possível
manter as lesões fechadas com gaze, o que diminuiu um
pouco o tempo de umidade oferecida ao leito da ferida, bem
como a absorção da exsudação quando necessário.
CONCLUSÃO
Conclui-se que o uso da pomada de Ficocianina na concentração
de 30% mostrou resultado semelhante à pomada
de referência – Kollagenase®, sendo capaz de promover a
contração mais rápida de feridas pela aceleração da primeira
fase da cicatrização e reação in amatória, maior concentração
de brose e produção de colágeno total se comparada à
pomada de referência no mercado.
É válido ressaltar que a Ficocianina acelera o processo
cicatricial, caracterizando-se como um tratamento
e ciente e de baixo custo. Sugere-se novas pesquisas para
possível aplicação em seres humanos, o que possibilitaria
minimizar o sofrimento de pessoas com lesões cutâneas
e aprimorar a terapêutica disponível com melhor custo
aos cofres públicos.
REFERÊNCIAS
1. Fontes IJG. Antioxidantes como substâncias cosmetologicamente
activas [dissertação]. Lisboa: Universidade Lusófona de
Humanidades e Tecnologias; 2013.
2. Santos MP. O papel das vitaminas antioxidantes na
prevenção do envelhecimento cutâneo. 2013 [citado em
2014 Ago 18]. Disponível em: http://bibliodigital.unijui.edu.
br:8080/xmlui/bitstream/handle/123456789/1571/TCC%20
Mirelli%20P%20dos%20Santos.pdf?sequence=1
3. Cohen VDF, Prazeres SJ, Silva ACB. Aspectos morfológicos
do tecido tegumentar. In: Prazeres SJ (org.). Tratamento de
feridas: teoria e prática. Porto Alegre: Moriá; 2009. p. 5-36.
4. Farage MA, Miller KW, Berardesca MH, Maibach HI. Clinical
implications of aging skin: cutaneous disorders in the elderly.
Am J Clin Dermat. 2009;10(2):73-86.
5. Mendonca RJ, Coutinho-Netto J. Aspectos celulares da
cicatrização. An Bras Dermatol. 2009;84(3):257-62.
6. Farina Junior JA, Almeida CEF, Garcia FL, Lima RVKS,
Marques RM, Cologna MHT. Tratamento multidisciplinar de
feridas complexas. Proposta de criação de “Unidades de
Feridas” no Hospital das Clínicas da FMRP-USP. Medicina.
2013;46(4):355-60.
7. Hildebrand KA, Gallant-Behm CL, Kydd AS, Hart DA. The
basics of soft tissue healing and general factors thatinfl uence
such healing. Sports Med Arthrosc Rev. 2005;13(3):136-44.
8. Martin P, Leibovich SJ. Infl ammatory cells during wound
repair: the good, the bad and the ugly. Trends Cell Biol.
2005;15(11):599-607.
9. Silva RCL, Figueiredo NMA, Meireles IB, Costa MM, Silva CRL.
Feridas: fundamentos e atualizações em enfermagem. São
Caetano do Sul: Yendis; 2007.
10. Santos JBD, Porto SG, Suzuki LM, Sostizzo LZ, Antoniazzi
JL. Avaliação e tratamento de feridas: orientações aos
profi ssionais de saúde. 2011 [citado em 2014 Ago 20].
Disponível em: http://www.lume.ufrgs.br/bitstream/
handle/10183/34755/000790228.pdf
11. Chow O, Barbul A. Immunonutrition: role in wound
healing and tissue regeneration. Adva Wound Care.
2014;3(1):46-53.
12. Mathes SJ, Hentz VR. Plastic surgery. Philadelphia, PA:
Saunders Elsevier; 2006.
13. Hatanaka E, Curi R. Ácidos graxos e cicatrização: uma
revisão. Rev Bras Farm. 2007;88(2):53-8.
14. Souza FT, Margarites AC, Colla LM, Costa JAV, Bertolin TE.
Avaliação ao potencial antioxidante da fi cocianina em
sistema lipídico óleo de soja e azeite de oliva. Alimentos e
Nutrição. 2007;17(3):275-79.
15. Chen HW, Yang TS, Chen MJ, Chang YC, Chen-Wang EI,
Ho CL, et al. Purifi cation and immunomodulating activity
of C-phycocyanin from Spirulina platensis cultured using
power plant fl ue gas. Process Biochem. 2014;29(8):1377-44.
16. Trabelsi L, Ouada HB, Bassa H. Activités biologiques des
métabolites excrétés par la cyanobactérie fi lamenteuse
Arthrospira platensis. Phytothér. 2010;8(5):282-9.
17. Ambrosi MA, Reinehr CO, Bertolin TBP, Costa JAV, Colla LM.
Propriedades de saúde de Spirulina spp. Rev Ciênc Farm
Básica e Apl. 2008;29(2):109-17.
18. Andrews SR, Sahu NP, Pal AK, Mukherjee SC, Kumar S. Yeast
extract, brewer’s yeast and Spirulina in diets for Labeo rohita
fi ngerlings aff ect haemato-immunological responses and
survival following Aeromonas hydrophila challenge. Res Vet
Sci. 2011;91(1):103-9.
19. Pereira T, Santos D, Lima-Ribeiro MHM, Pontes-Filho NT,
Carneiro-Leão AMDA, Correia MTDS. Development of animal
model for studying deep second-degree thermal burns.
J Biomed Biotechnol. 2012. Disponível em: www.hindawi.
com/journals/jbb/2012/460841/cta/.
20. Monteiro M, Peixoto B. Behavioural Assessment of the
Dysexecutive Syndrome (BADS) on the context of normal
and pathological aging. Rev Bras Geriatr Gerontol. 2014;
17(2):407-416.
21. Guo S, Dipietro LA. Factors aff ecting wound healing. J Dent
Res. 2010;89(3):219-29.
22. Panigrahi BB, Panda PK, Patro VJ. Wound healing activity of
spirulina extracts. International Journal of Pharmaceutical
Sciences Review and Research. 2011;6(2):132-5.
23. Madhyastha H, Madhyastha R, Nakajima Y, Omura S,
Maruyama M. Regulation of growth factors-associated
cell migration by C-phycocyanin scaff old in dermal wound
healing. Clin Exp Pharmacol Physiol. 2012;39(1):13-9.
24. Sonnemann KJ, Bement WM. Wound repair: toward
understanding and integration of single-cell and multicellular
wound responses. Annu Rev Cell Dev Biol. 2011;27:237-63.
25. Pristo I. Cicatrização de feridas: fases e fatores de infl uência.
Acta Veterinaria Brasílica. 2013;6(4):267-71.


























